Curso Internacional de Tumores Músculo-Esqueléticos

  |
27 de septiembre de 2013
Redacción / El Sol de México
Ciudad de México.- El doctor Genaro Rico y su equipo que son unos de los especialistas más prestigiados de América Latinan en el manejo de los tumores de hueso, (es el profesor titular y jefe de servicios de "Tumores Óseos" del Instituto Nacional de Rehabilitación que preside el doctor Luis Guillermo Ibarra), organiza en el Instituto Nacional de Rehabilitación y con el aval del Colegio Mexicano de Ortopedia el "Curso Internacional de Tumores Músculo-Esqueléticos" a realizarse el 2, 3 y 4 de octubre del 2013; aprovechando este evento para hacer un reconocimiento al Dr. Sergio Estrada Parra Premio Nacional de Ciencias y Artes 2012, en el Auditorio Nanahuatzin el 2 y 3 de octubre, y en la Sala Tenazcapati el 4 del mismo mes.
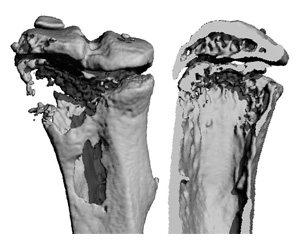
El curso está enfocado para disertar sobre los tumores óseos, que son es una proliferación anormal de células en el hueso y pueden ser benignos o malignos. Se hablará entre otros temas de cómo poder prevenir los cánceres que comienzan en los huesos que se denominan tumores óseos primarios. También se tocarán temas relacionados con los cánceres que comienzan en otra parte del cuerpo (como las mamas, los pulmones o el colon) son tumores secundarios o tumores óseos metastásicos que se comportan de manera muy diferente de los tumores óseos primarios. El mieloma múltiple a menudo afecta o compromete el hueso, pero no se considera un tumor óseo primario. Aquí cabe informar, que antes el cáncer de hueso fue muy frecuente entre personas que fabricaban cuadrantes con brillo en la oscuridad usando pintura de radio. De tal manera la práctica de usar pintura de radio fue abandonada a mediados del siglo XX. Ahora el cáncer de hueso es más común en familias con antecedentes de síndromes cancerígenos. Las formas de presentación son variadas, algunos de los síntomas son: 1.- Fractura ósea, en especial a causa de una ligera lesión (trauma). 2.- Dolor óseo, que puede empeorar en la noche. 3.-Ocasionalmente, se puede sentir una masa e inflamación en el lugar del tumor. Así cabe informar que la mayoría de los pacientes con tumores óseos cancerosos que no se han diseminado pueden curarse. La tasa de curación depende del tipo de cáncer, localización, tamaño y otros factores.
De tal manera se informa a continuación el programa para difundir los conceptos actuales en el tratamiento de los Tumores Músculo-Esqueléticos. Y que va dirigido a: Médicos especialistas en Ortopedia, Oncología, Quimioterapia, Radioterapia, Rehabilitación, Reumatología, Residentes de Especialidades afines, Ing. Biomédicos, Médicos Generales y Enfermeras. El curso se impartirá, entre otros por el profesor titular Dr. Genaro Rico Martínez, los profesores adjuntos Dr. Luis Miguel Linares G. y el Dr. Ernesto A. Delgado, con el profesor invitado Dr. Eduardo Sadao del hospital La Santa Casa. Estarán también como invitados los médicos especialistas de: El Hospital la Santa Casa Sao de Paulo, Brasil, del Hospital Salvador Zubirán, la Universidad Nacional Autónoma de México, Universidad Autónoma de Nuevo León, Hospital General Naval de Alta Especialidad, ENCB Instituto Politécnico Nacional, CM La Raza IMSS, Hospital Español, Hospital de Ortopedia Victorio de la Fuente, Narváez IMSS, Hospital de Traumatología y Ortopedia, IMSS Monterrey, N. L., Instituto Nacional de Rehabilitación-Ortopedia. INFORMES: 59 99 10 00 Ext. 12715 Instituto Nacional de Rehabilitación; Servicio de Tumores Óseos. Av. México Xochimilco 289 Col. Arenal de Guadalupe, Delegación Tlalpan, con valor curricular.
Ciudad de México.- El doctor Genaro Rico y su equipo que son unos de los especialistas más prestigiados de América Latinan en el manejo de los tumores de hueso, (es el profesor titular y jefe de servicios de "Tumores Óseos" del Instituto Nacional de Rehabilitación que preside el doctor Luis Guillermo Ibarra), organiza en el Instituto Nacional de Rehabilitación y con el aval del Colegio Mexicano de Ortopedia el "Curso Internacional de Tumores Músculo-Esqueléticos" a realizarse el 2, 3 y 4 de octubre del 2013; aprovechando este evento para hacer un reconocimiento al Dr. Sergio Estrada Parra Premio Nacional de Ciencias y Artes 2012, en el Auditorio Nanahuatzin el 2 y 3 de octubre, y en la Sala Tenazcapati el 4 del mismo mes.
El curso está enfocado para disertar sobre los tumores óseos, que son es una proliferación anormal de células en el hueso y pueden ser benignos o malignos. Se hablará entre otros temas de cómo poder prevenir los cánceres que comienzan en los huesos que se denominan tumores óseos primarios. También se tocarán temas relacionados con los cánceres que comienzan en otra parte del cuerpo (como las mamas, los pulmones o el colon) son tumores secundarios o tumores óseos metastásicos que se comportan de manera muy diferente de los tumores óseos primarios. El mieloma múltiple a menudo afecta o compromete el hueso, pero no se considera un tumor óseo primario. Aquí cabe informar, que antes el cáncer de hueso fue muy frecuente entre personas que fabricaban cuadrantes con brillo en la oscuridad usando pintura de radio. De tal manera la práctica de usar pintura de radio fue abandonada a mediados del siglo XX. Ahora el cáncer de hueso es más común en familias con antecedentes de síndromes cancerígenos. Las formas de presentación son variadas, algunos de los síntomas son: 1.- Fractura ósea, en especial a causa de una ligera lesión (trauma). 2.- Dolor óseo, que puede empeorar en la noche. 3.-Ocasionalmente, se puede sentir una masa e inflamación en el lugar del tumor. Así cabe informar que la mayoría de los pacientes con tumores óseos cancerosos que no se han diseminado pueden curarse. La tasa de curación depende del tipo de cáncer, localización, tamaño y otros factores.
De tal manera se informa a continuación el programa para difundir los conceptos actuales en el tratamiento de los Tumores Músculo-Esqueléticos. Y que va dirigido a: Médicos especialistas en Ortopedia, Oncología, Quimioterapia, Radioterapia, Rehabilitación, Reumatología, Residentes de Especialidades afines, Ing. Biomédicos, Médicos Generales y Enfermeras. El curso se impartirá, entre otros por el profesor titular Dr. Genaro Rico Martínez, los profesores adjuntos Dr. Luis Miguel Linares G. y el Dr. Ernesto A. Delgado, con el profesor invitado Dr. Eduardo Sadao del hospital La Santa Casa. Estarán también como invitados los médicos especialistas de: El Hospital la Santa Casa Sao de Paulo, Brasil, del Hospital Salvador Zubirán, la Universidad Nacional Autónoma de México, Universidad Autónoma de Nuevo León, Hospital General Naval de Alta Especialidad, ENCB Instituto Politécnico Nacional, CM La Raza IMSS, Hospital Español, Hospital de Ortopedia Victorio de la Fuente, Narváez IMSS, Hospital de Traumatología y Ortopedia, IMSS Monterrey, N. L., Instituto Nacional de Rehabilitación-Ortopedia. INFORMES: 59 99 10 00 Ext. 12715 Instituto Nacional de Rehabilitación; Servicio de Tumores Óseos. Av. México Xochimilco 289 Col. Arenal de Guadalupe, Delegación Tlalpan, con valor curricular.